


活性氧(ROS)是生物系统中短暂存在但必不可少的重要物质。ROS的产生和消除是基本的生物化学过程,其微妙的平衡由一组复杂的分子机制维持。氧化还原稳态的失衡与各种疾病,尤其是癌症密切相关。细胞中ROS的普遍升高被认为是在肿瘤的发生发展中发挥重要作用。因此,通过靶向ROS及其调控机制调节细胞氧化还原被认为是癌症治疗的有效策略。
近日,中山大学肿瘤防治中心黄蓬教授团队在Nature Reviews drug discovery 杂志上发表了一篇题为:靶向肿瘤活性氧的原理与治疗策略的长篇综述(点击查看)。这是黄蓬教授继2009年后发表题为:ROS介导机制靶向癌症细胞:一种全新的治疗方法的论文后,第二次在该杂志上发表论文。此次发表的文章总结了该领域近十多年取得的重大进展,包括发现了新的氧化还原信号通路,ROS对肿瘤代谢、肿瘤免疫、相分离、肿瘤干细胞、细胞命运的影响,以及靶向ROS的新型抗癌剂。该文章探讨了这些研究进展对肿瘤治疗和药物研发的影响和应用,并剖析ROS领域的新概念、争议热点和未来研究方向。

肿瘤中的氧化还原信号
ROS介导的信号传导主要发生于转录因子和表观遗传学的氧化还原修饰,通过影响转录过程传递氧化还原信号。ROS通过激活或抑制氧化还原敏感转录因子和修饰关键代谢酶而调节关键代谢途径。高ROS能引起线粒体膜电位去极化和损伤呼吸链,导致线粒体生成更多O2-,从而引发癌症细胞中ROS产生的恶性循环。肿瘤微环境中的ROS可刺激癌症细胞和肿瘤相关巨噬细胞(TAM)中的NF-κB和AP-1等氧化还原敏感通路,导致炎症因子的释放。这些炎症因子到达远处器官,如肌肉和脂肪组织,并与这些组织细胞中的特异性受体相互作用,诱导ROS的产生,进而激活NF-κB和FOXO等转录因子,导致消耗性代谢变化、蛋白质和脂质降解,引发肿瘤恶病质(见图1)。
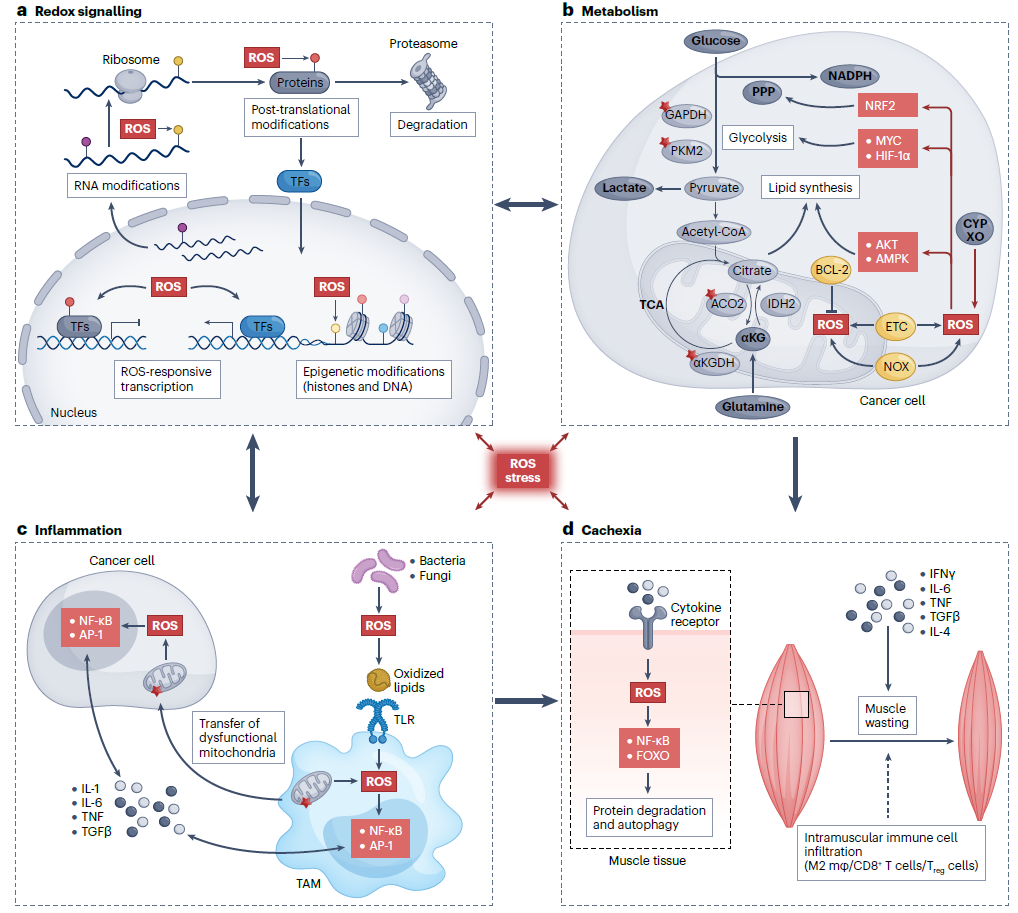
图1. ROS介导的信号传导过程及其对肿瘤代谢、肿瘤微环境和免疫功能的影响
ROS与肿瘤免疫
ROS对肿瘤细胞和免疫系统的作用具浓度依赖性。在免疫细胞中,生理范围内的ROS升高可促进细胞因子和其他效应物的代谢、合成和分泌;癌症细胞产生高水平的ROS和免疫抑制分子,如PD-L1和乳酸盐,对免疫细胞具有负调控作用。具有GSH合成活性的成纤维细胞可促进癌症细胞抗氧化功能,从而导致化疗耐药性。肿瘤微环境(TME)中的过量ROS可通过氧化关键免疫分子导致免疫细胞功能障碍,并抑制树突状细胞(DC)和T细胞之间的信号呈递。由于免疫抑制细胞(如M2巨噬细胞、髓源性抑制细(MDSC)和调节性T细胞(Treg))具有更高的抗氧化能力,因此高水平的ROS可能利于选择免疫抑制细胞。严重的ROS应激可能导致免疫细胞死亡,这是由于ROS引起的DNA突变和线粒体功能障碍导致代谢应激,产生更多ROS,从而对生物分子和细胞造成损害并导致细胞死亡(见图2)。
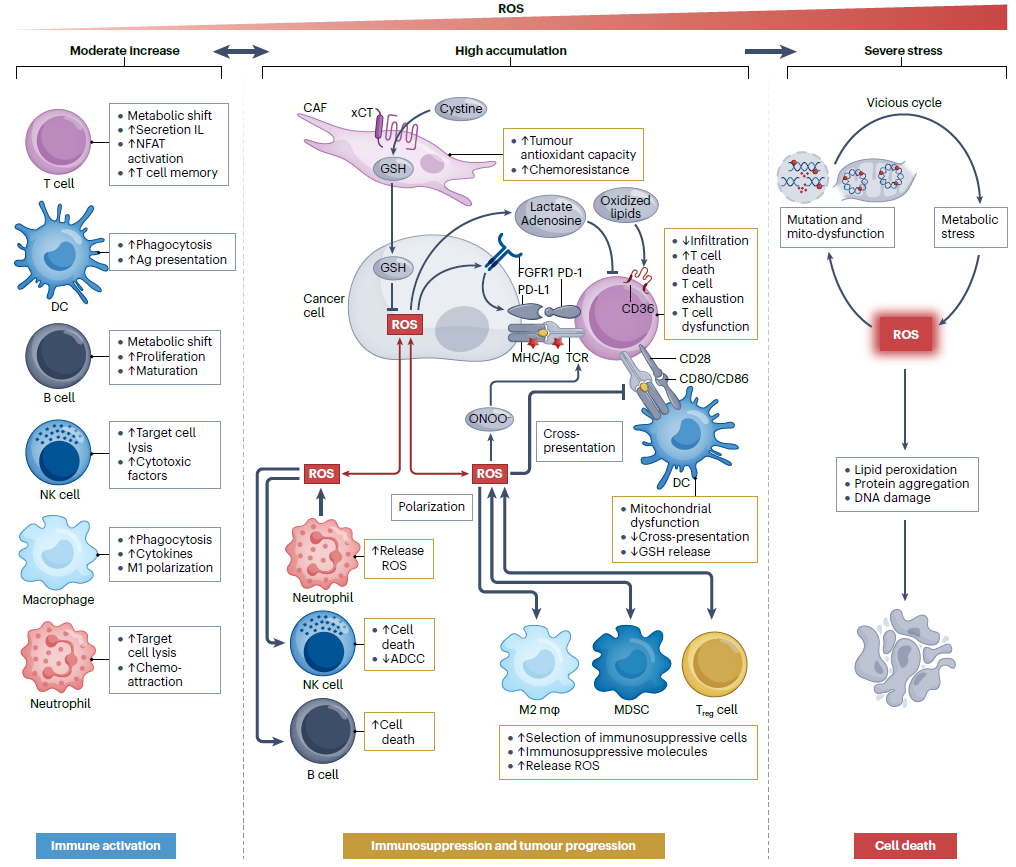
图2. ROS对肿瘤和免疫细胞功能影响的剂量效应
ROS与相分离
ROS领域中一个新的研究方向是相分离。相分离通过形成无膜细胞器调控细胞生物学过程,其状态受多种物理生化因素的影响,其中活性氧是重要的影响因素之一。ROS通过多种途径调节相分离:(1)H2O2通过氧化蛋氨酸残基促进凝聚物Pbp1的解聚;(2)诱导应激颗粒(SGs)的形成以隔离翻译核糖体和mRNA,使之免受异常氧化;(3)促进P-body的形成降解氧化损伤的蛋白质和RNA;(4)刺激脂滴的形成以防止脂质过氧化;(5)在缺氧条件下诱导糖酵解小体(G body)的形成,提高糖酵解的代谢效率;(6)通过形成p62自噬体降解KEAP1从而释放NRF2,促进抗氧化信号转导。
ROS与肿瘤干细胞
ROS与抗氧化剂之间的平衡在调节肿瘤干细胞(CSCs)的可塑性中起着重要作用。低水平ROS维持CSCs的静息状态,而高水平ROS则通过刺激MAPK/ERK和NOTCH1信号通路促进干细胞向增殖状态转变。静息期CSCs中高水平的GSH使其对化疗和放疗不敏感。增殖期CSCs中ROS升高使得NRF2及其他抗氧化途径激活,这些途径促进细胞在应激状态下存活并导致耐药性。CSCs在静息和增殖状态之间转变的灵活性为间充质-上皮转化和上皮-间充质转化对癌症转移提供了重要的机制。
ROS与细胞命运
严重或持续的ROS介导损伤可导致程序性细胞死亡,包括:铁死亡、焦亡、凋亡、氧死亡和NETosis。肿瘤细胞和免疫细胞响应ROS应激而经历特定类型的程序性细胞死亡由其内在的基因、代谢状态以及ROS的水平和类型决定。复制应激所诱导的细胞衰老相关的氧化还原状态由O2-特异性驱动;放化疗可诱导不同类型的细胞死亡,并且由此产生的细胞内容物释放可激活免疫系统对肿瘤细胞发起第二次攻击。文章重点介绍了ROS对铁死亡和焦亡的诱导和调控机制。
靶向ROS策略
ROS产生和消除之间的平衡被破坏对肿瘤细胞的存活和药物敏感性具重要影响。氧化还原调节治疗策略包括靶向ROS的产生和消除氧化还原的适应机制。刺激ROS的产生和/或抑制抗氧化系统诱导氧化应激,导致细胞损伤、抑制细胞增殖和促进细胞死亡,这取决于ROS应激的水平和持续时间(见图3)。
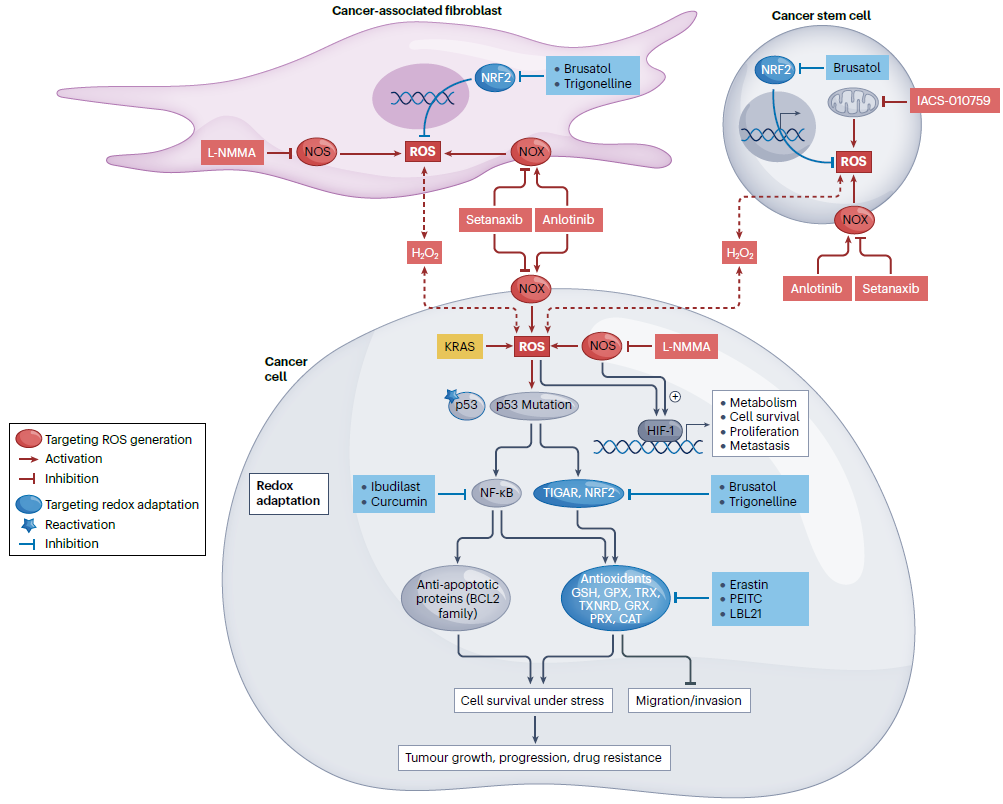
图3. 靶向ROS的抗肿瘤策略
长期以来,抗氧化剂在癌症治疗中的作用一直存在争议。最近关于氧化还原调节和抗氧化剂对免疫细胞和癌症细胞影响的研究结果为抗氧化剂的促肿瘤和抗肿瘤作用提供了重要的机制解释。该领域的未来研究应在实验设计和数据解释中全面考量ROS对肿瘤细胞和免疫系统两者的影响;抗氧化剂和氧化还原调节治疗的使用应根据肿瘤的不同分期、肿瘤细胞的氧化还原状态和患者个体的免疫功能进行个性化评估和检测,并据此设计相应的干预策略。
问题和挑战
ROS在肿瘤发生发展中的复杂角色:ROS的促肿瘤和抗肿瘤作用在该领域中长期以来一直是个悖论,不同研究者报道不同甚至相互矛盾的研究结果,这可能是由于不同的研究模型和研究方法造成的。一项最新研究表明,ROS在胰腺癌发展的不同阶段起不同作用,ROS抑制肿瘤的发生但在后期促进肿瘤转移,TIGAR是该变化过程的一个关键调控因子。因此,ROS的时空调控及其在肿瘤发展不同阶段的动态效应可能在一定程度上部分解释抗氧化剂在肿瘤治疗中的争议角色。
区分不同ROS种类及其亚细胞定位的必要性和技术挑战:ROS包括具有不同特性的(化学反应性、半衰期、膜通透性等)多种含氧化学物质。由于多种活性氧在细胞内可快速互相转换或代谢为不同种类,为方便描述,文献中广泛使用了ROS这一缩写。然而,ROS的模糊使用可能导致概念混淆和不正确的数据解释,甚至得出错误的结论。因此,使用适当的分析工具准确区分不同的氧化剂种类及其定位是该领域的一个重要问题。由于不同氧化剂种类之间的快速互相转换,把观察到的生物学改变归因于某种特定的活性氧种类是一个挑战。此外,由于某些ROS检测方法使用化学探针与氧化剂反应,它们可能会改变细胞的氧化还原状态和细胞功能。因此,所得数据应谨慎解释。
基于ROS抗肿瘤治疗的前景与挑战:氧化还原调节长期以来被认为是一种有前途的抗癌治疗策略,但临床前和临床结果却相互矛盾,这表明需要仔细评估不同的实验模型和人体氧化还原调控的相似性和不同。近期的研究进展包括:(1)发现ROS在肿瘤发生发展不同阶段的动态调控;(2)发现肿瘤干细胞不同表型与ROS水平及氧化还原调控机制的内在联系;(3)使用氧化还原调节剂与糖酵解抑制剂、抗坏血酸和化疗药物相结合策略,在实验模型和临床试验中实现提高抗肿瘤疗效和选择性;(4)开发具有显著抗肿瘤活性的创新ROS调节剂。尽管取得了这些显著进展,但仍存在重大挑战。例如,目前尚不清楚为何肿瘤细胞和正常细胞对同样的ROS调节剂反应不同;抗氧化剂在肿瘤治疗中的作用仍然存在争议;用于检测体内氧化还原变化的分析方法有限。解决这些挑战对未来研究至关重要。
华南恶性肿瘤防治全国重点实验室黄蓬教授是本论文通讯作者,刘湜桦副研究员、Christophe Glorieux副研究员是本论文的第一作者。