


这项研究,为攻克EB病毒感染做出重要探索!
EB病毒(Epstein-Barr virus, EBV)属于人类疱疹病毒4型,是当前严重威胁人类健康的主要传染病原之一,全球每年报告超过20万例EBV感染相关的肿瘤疾病,如鼻咽癌、EBV阳性胃癌和淋巴瘤等。然而,迄今仍没有针对该病毒的有效疫苗和特异性抗病毒药物上市。
11月16日,华南肿瘤学国家重点实验室曾木圣教授团队与清华大学医学院张林琦团队以及清华大学生命科学学院王新泉团队合作,在Nature Communications杂志在线发表题为“一种靶向EB病毒新易感性表位的有效保护性人源中和抗体”的研究论文https://www.nature.com/articles/s41467-021-26912-6。
该研究为未来EBV疫苗以及预防和治疗EBV感染的候选药物的合理设计提供了宝贵的循证医学依据。
研究发现1D8抗体能有效阻断EBV的感染
EBV表面糖蛋白gH/gL是介导病毒进入细胞的关键分子,也是诱发机体产生中和抗体的重要靶点。因此,该研究首先从EBV感染者的单个B淋巴细胞中分离并鉴定能与EBV糖蛋白gH/gL特异性结合的单克隆抗体,并通过体外中和实验,筛选出能同时高效中和EBV感染上皮细胞和B细胞的精英抗体1D8,其在B细胞和上皮细胞中的IC50分别为0.23 μg/ml和0.12 μg/ml(图1)。
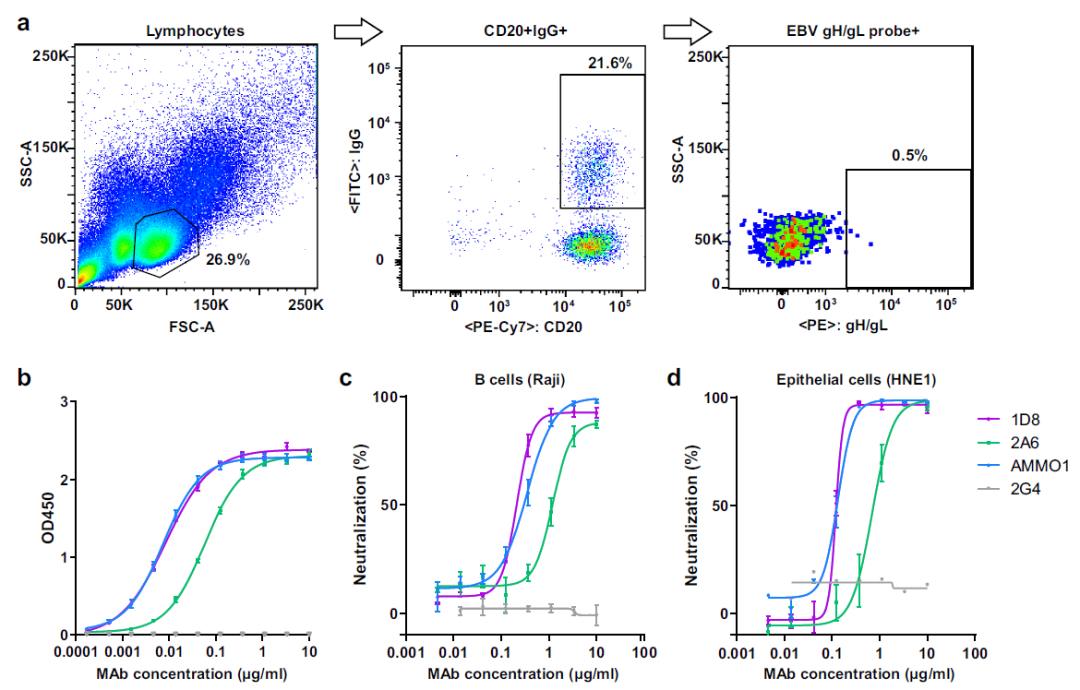
图1.抗EBV中和性抗体的分离和鉴定
为了进一步研究抗体1D8的体内中和效果,该合作组利用人源化小鼠模型,对小鼠进行尾静脉注射EBV的前一天,预先对小鼠进行腹腔注射1D8等单克隆抗体,并在攻毒后对小鼠再进行每周一次的抗体注射。
结果显示,注射1D8抗体组小鼠外周血和组织中的病毒拷贝数,以及外周血人CD20+B细胞的下降速度和人CD3+T细胞的上升速度均显著低于阴性对照2G4抗体组和空白对照PBS组。并且1D8抗体注射后能维持小鼠的正常体重,保护小鼠因感染EBV所出现的死亡(图2)。

图2.1D8对人源化小鼠致死性EB病毒感染的保护作用
此外,从脾脏大体结果上看,注射1D8抗体组的小鼠脾脏外观大小正常,相比之下,阴性对照2G4抗体组和空白对照PBS组小鼠的脾脏明显增大,出现肉眼可见的白色肿瘤组织。免疫组化结果显示,2G4和PBS组脾脏出现弥漫成片的CD20+EBER+的异形淋巴细胞,呈现出典型的弥漫大B淋巴瘤(图3)。
以上结果均表明1D8抗体能有效抑制EBV在人源化小鼠体内的复制,抑制EBV诱导淋巴瘤的形成。
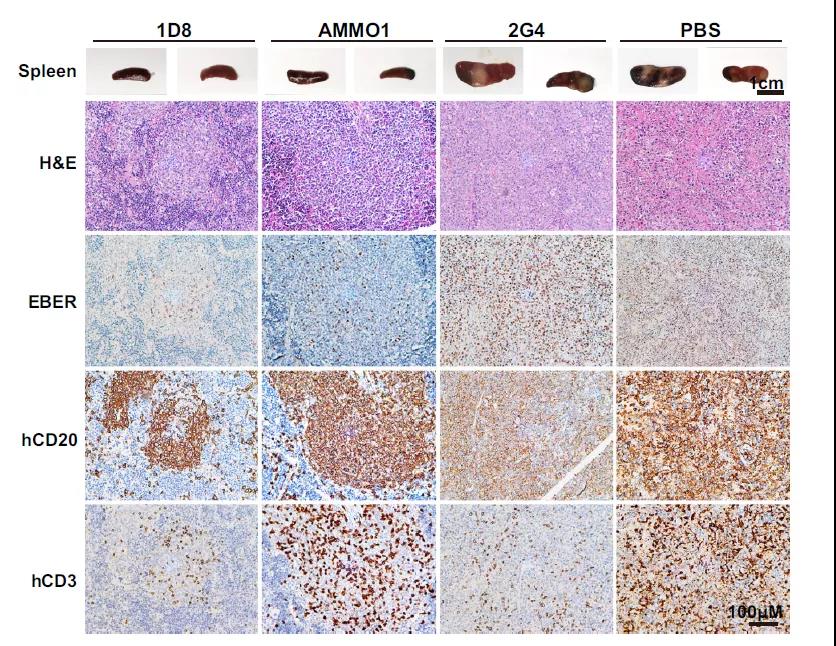
图3. 1D8在人源化小鼠中抑制EB病毒复制和组织损伤
对1D8抗体的中和作用机制做出探索
为了深入探究抗体的中和机制,该合作组利用X射线晶体学方法,解析了1D8抗体与gH/gL抗原的复合物结构。结果显示1D8结合在gH/gL 功能域1与功能域2所形成的凹槽上方,该结合表位均不同于以往报道的gH/gL抗体结合表位(图4)。
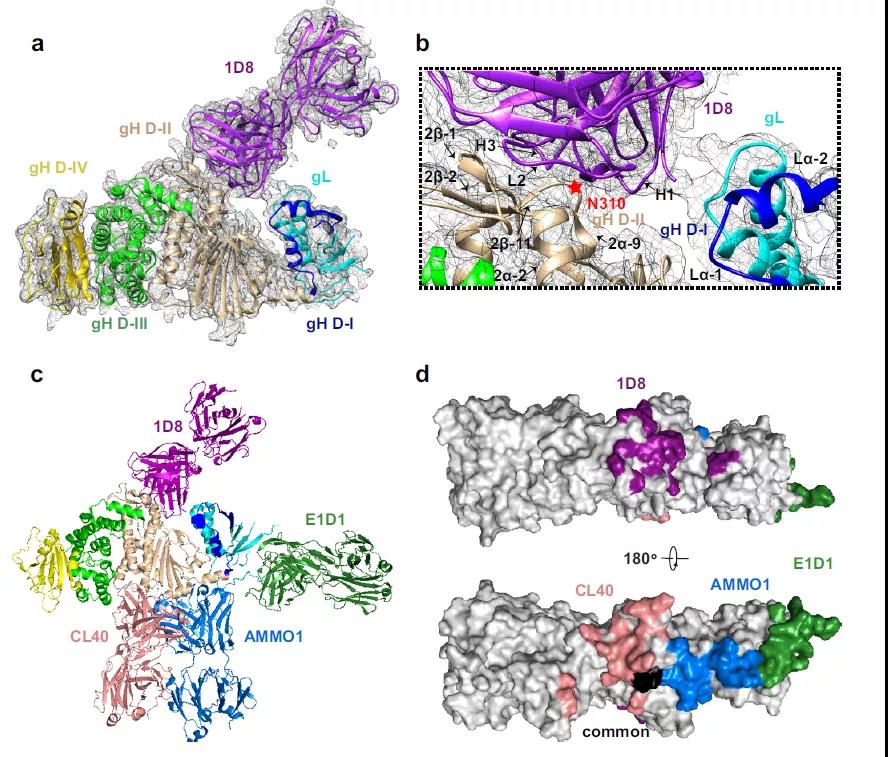
图4. 1D8靶向于gH/gL上的新表位
EBV进入宿主细胞需要经过结合和融合过程,因此该合作组进一步探索1D8抗体对病毒感染过程的影响。通过无病毒细胞融合实验,研究者发现1D8抗体能几乎完全阻断病毒的融合过程。此外,1D8还能一定程度的抑制gH/gL与B细胞和上皮细胞的结合,并且在上皮细胞中的抑制作用更为显著。
由于课题组前期发现的EphA2是EBV感染上皮细胞的重要受体,因此研究者进一步探究1D8能否抑制gH/gL与EphA2的结合。通过BLI竞争结合实验发现,1D8抗体与EphA2存在明显的竞争结合gH/gL的关系,而对照抗体AMMO1和2G4则不存在竞争作用(图5)。

图5. 1D8干扰EBV与细胞的融合和结合
综上,该研究发现的1D8抗体揭示了一个全新的EBV易感性表位,有助于指导EBV疫苗的合理设计。基于该表位设计的亚单位疫苗有望诱导出与1D8抗体相似的中和抗体。此外,1D8抗体也可作为一种潜在的预防和治疗EBV感染的候选药物。
››››››
据悉,中山大学肿瘤防治中心实验研究部朱倩莹博士、清华大学医学院单思思博士以及清华大学生命科学学院余锦芳博士为本文的共同第一作者。清华大学医学院张林琦教授、中山大学肿瘤防治中心曾木圣教授以及清华大学生命科学学院王新泉教授为本文的共同通讯作者。中山大学肿瘤防治中心曹素梅教授、北京艾德摩生物技术有限公司彭思颖博士为该工作提供了大量的帮助和指导。该研究得到了国家重点研发计划、国家自然科学基金、广东省重点研发项目和北京市科学技术委员会的资助。