


2022年10月24日,华南肿瘤学国家重点实验室康铁邦研究员团队在《细胞研究》(Cell Research)上发表题为“RAB22A介导的非经典自噬调控激活型STING的胞间转移促进抗肿瘤免疫”的文章。该研究命名了一种新型细胞器Rafeesome(RAB22A-regulated non-canonical autophagosome fused with early endosome),它介导了激活型STING的胞外分泌,并且具有抗肿瘤免疫功能。

cGAS-cGAMP-STING信号通路在天然免疫中发挥重要作用。环鸟嘌呤核苷酸腺嘌呤核苷酸(cyclic GMP-AMP,cGAMP)合成酶(cGAMP synthase,cGAS)感受细胞质DNA刺激后产生环鸟嘌呤核苷酸腺嘌呤核苷酸,作为干扰素基因刺激分子(stimulator of interferon genes,STING)的天然激动剂,环鸟嘌呤核苷酸腺嘌呤核苷酸和干扰素基因刺激分子结合后,激活TANK结合激酶1(TANK-binding kinase 1,TBK1),进而诱导干扰素β(interferon β,IFNβ)的产生,补充干扰素β在先天性免疫中的功能。同时,干扰素β可以选择性地刺激肿瘤抗原的交叉递呈,动员肿瘤特异性T细胞,从而启动对抗肿瘤的适应性免疫应答。
以干扰素基因刺激分子为靶标的小分子激动剂在抗肿瘤免疫领域已经取得一定进展,由于其成药性和吸收性的问题,干扰素基因刺激分子激动剂的作用具有一定局限性,其临床试验仍有待探索。本研究希望将干扰素基因刺激分子的抗肿瘤免疫作用更好地推向临床,研究其胞内胞外信号传导方式,为以干扰素基因刺激分子为靶点的治疗策略提供新的思路。
 研究示意图
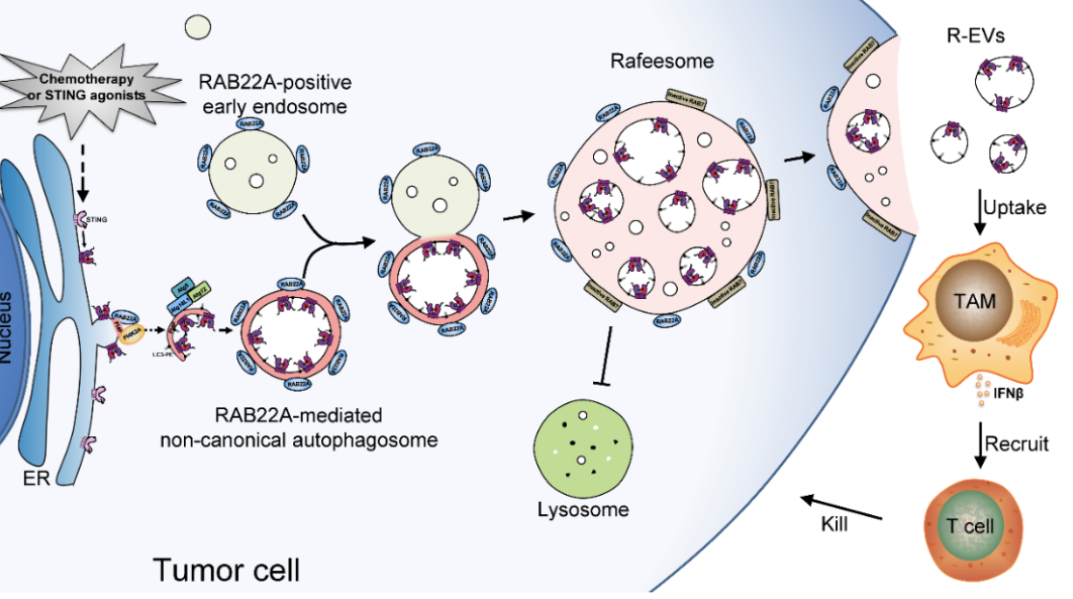
研究示意图康铁邦团队发现,激活型干扰素基因刺激分子可以在细胞间转移,促进抗肿瘤免疫,这一过程是由RAB22A介导的非经典自噬触发的。机制上,RAB22A与PI4K2A结合产生PI4P,PI4P募集Atg12-Atg5-Atg16L1复合体,促进ER来源的非经典自噬体形成,而这种非经典自噬体携带着激活型干扰素基因刺激分子(放化疗、其激动剂等均可诱导),然后,该非经典自噬体与RAB22A阳性的早期内体融合,产生一个新的类似于MVB的细胞器,命名为Rafeesome。
同时,RAB22A使RAB7失活,抑制Rafeesome与溶酶体的融合,促进Rafeesome与细胞膜融合,从而该非经典自噬体的内层囊泡(携带着激活型STING)释放到细胞外,成为一种新的细胞外囊泡,定义为R-EV(RAB22A-induced extracellular vesicle)。含有激活型干扰素基因刺激分子的R-EV被受体细胞摄取,诱导干扰素β表达,释放干扰素β到肿瘤微环境,促进抗肿瘤免疫。进一步揭示了RAB22A能够增强干扰素基因刺激分子激动剂diABZI在小鼠体内的抗肿瘤作用,鼻咽癌放化疗患者肿瘤组织中RAB22A高表达有更好的生存率,血清中干扰素基因刺激分子高水平对放化疗有更好的响应率。
已有研究表明干扰素基因刺激分子在细胞内发挥抗肿瘤功能后被降解,而该研究发现激活的干扰素基因刺激分子可以通过Rafeesome介导分泌到肿瘤微环境中,被巨噬细胞、成纤维细胞等摄取,激活受体细胞的STING-TBK1-IRF3信号通路,继续触发和传播抗肿瘤免疫功能。该研究发现的激活型STING EVs为肿瘤免疫治疗方案的开发提供了新的视角。
中山大学肿瘤防治中心/华南肿瘤学国家重点实验室康铁邦研究员、魏灯辉特聘副研究员为共同通讯作者,高瑛博士后、郑雪萍博士研究生、林雨洁博士研究生等为共同第一作者。康铁邦课题组以通讯作者在Nature Cell Biol, Cell Res, J Clin Invest, Nat Commun 等期刊发表学术论文50余篇。
课题组长期招聘博士后
欢迎有志者加盟!
联系邮箱:kangtb@sysucc.org.cn