


近日,华南恶性肿瘤防治全国重点实验室杨江课题组联合微创介入治疗科范卫君课题组在Nature Index期刊Advanced Materials上在线发表了题为“器官靶向性二氧化铪纳米药物通过多拟酶活性抑制辐射导致的组织损伤”的论文(点击阅读原文查看),报道了一种具有器官靶向选择性、多种仿生酶催化活性的二氧化铪纳米药物。研究发现依靠Hf(0)/Hf(IV) 氧化还原对,能有效清除放疗中产生的活性氧 (ROS),保护正常组织免受辐照所致的炎性损伤,具有“放疗减毒”并降低炎性损伤风险的临床转化潜力。该研究首次揭示了二氧化铪的辐射防护效应,为放疗保护提供了一种新的设计思路。

放射治疗是最常规的肿瘤治疗手段之一,但通常会对正常组织产生全身或局部的脱靶毒性,引起急性或慢性辐射综合症,造成器官损伤。因此,在保证放疗对癌细胞的充分杀伤前提下,放疗引发的正常组织损伤、毒副作用和后遗症是限制放疗效果的重要因素。尽管目前已有氨磷汀和帕利弗明等药物被批准用于辐射防护,但其有限的防护效果、短半衰期、较差的稳定性和临床副作用极大地限制了相关药物的广泛临床应用。
由国际纯粹与应用化学联合会(IUPAC)选出的2022年10大科技进展之一为具仿生酶活性的纳米酶。尽管其具有清除自由基、降低氧化应激的特性,但缺乏靶向性的缺点使其不可避免地有脱靶药理作用。为了解决这一难题,中山大学肿瘤防治中心杨江课题组联合微创介入治疗科范卫君课题组进行了相关研究。研究报道了一种具有器官靶向选择性、多种仿生酶催化活性的二氧化铪纳米药物,依靠Hf(0)/Hf(IV) 氧化还原对,能有效清除放疗中产生的活性氧(ROS),保护正常组织免受辐照所致的炎性损伤,具有“放疗减毒”并降低风险的临床转化潜力。
该研究首次揭示了二氧化铪的辐射防护效应,颠覆了此前其仅能作为放疗增敏剂的常规认知。
目前,由法国上市公司Nanobiotix研发的first-in-class放疗增敏的二氧化铪(HfO2)纳米药物Hensify® (NBTXR3),获美国食品药品监督管理局(FDA)授予快速通道资格,在欧洲和美国已获批用于放疗增敏治疗头颈部鳞状细胞癌(HNSCC),同时在中国也已进入三期临床试验。
器官靶向性二氧化铪纳米颗粒(SORT HfO2 NPs)通过金属前驱物在碱性环境下结合α-乳清蛋白(α-LA)反应形成。能谱CT成像可见,不同大小的SORT HfO2 NPs能选择性靶向驻留在特定的放射敏感性指数(RSI)较低的正常器官肺、肝脏和肾脏中。SORT HfO2 NPs具备多种拟酶活性,能清除包括O2•-、OOH• 、OH• 和 H2O2等多种ROS。其能通过催化清除放疗所致的自由基,能有效防护放射敏感的组织器官免受辐照所致的放射损伤。
在小鼠及兔子全身辐照模型中,SORT HfO2 NPs能恢复机体内受损的抗氧化防御系统,并延长动物的生存时间,特异性靶向降低组织内的炎症水平。通过RNA测序分析,SORT HfO2 NPs能抑制FoxO、Hippo及TGF-β通路来降低细胞内放疗所致的炎症反应。综上所述,该研究首次揭示了二氧化铪的辐射防护作用,为放疗保护提供了一种新的设计思路,结合其器官靶向及CT造影的特性,使其有潜力成为一种缩短辐照持续时间或增加剂量的放疗保护性药物。
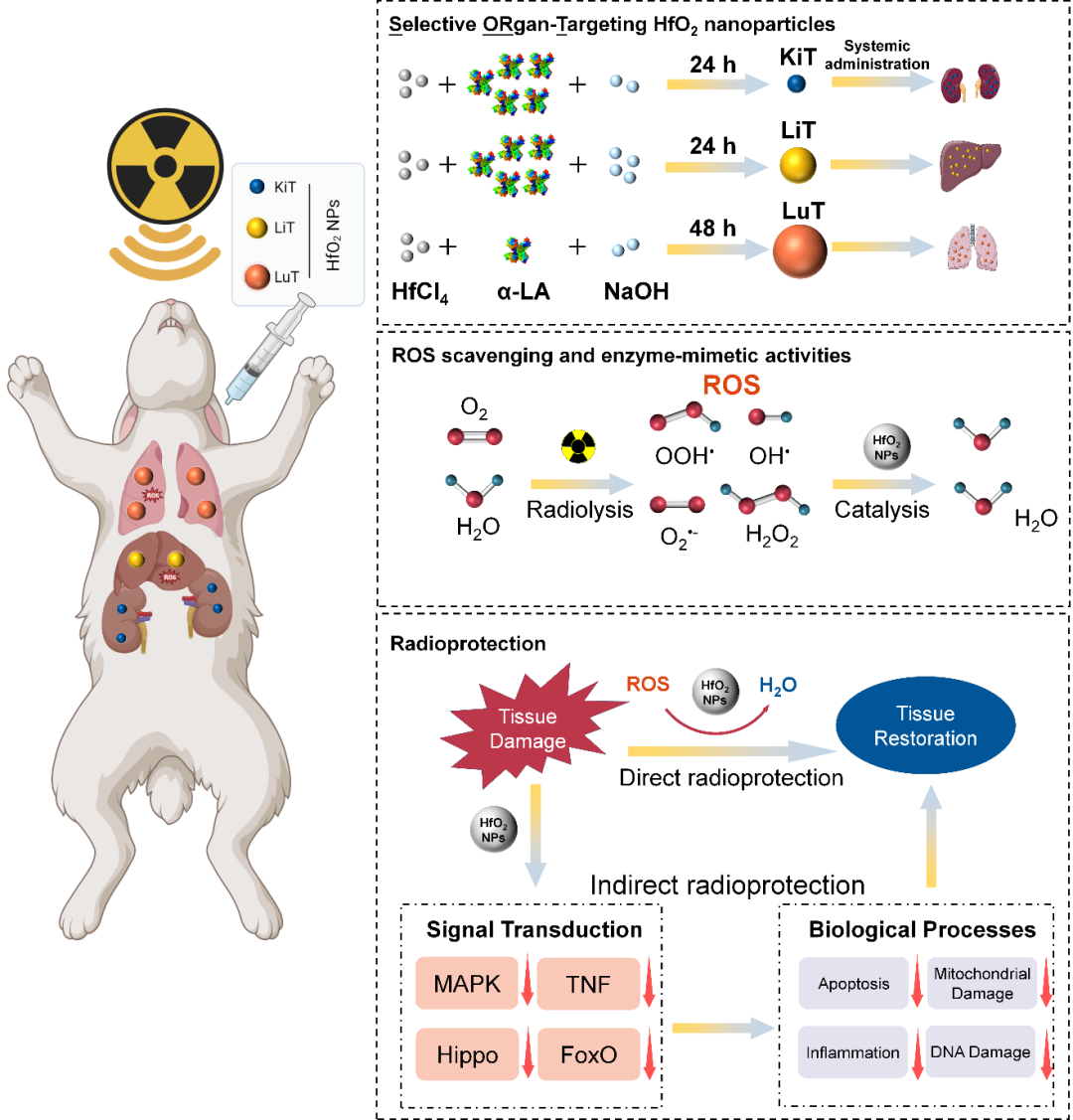
SORT HfO2 NPs对小鼠和兔子的器官靶向性放射防护及其作用机制
中山大学肿瘤防治中心、华南恶性肿瘤防治全国重点实验室杨江研究员与微创介入治疗科范卫君教授为论文的共同通讯作者。中山大学肿瘤防治中心博士刘鼎鑫、微创介入治疗科博士后曹飞、佛山市第一人民医院影像科徐志锋主任医师为本文共同第一作者。中山大学肿瘤防治中心刘泽先研究员、赵春花博士、刘泽坤博士后、庞家栋博士后、新西兰奥塔哥大学Mahdieh Moghiseh博士、Anthony Butler教授及Perkin Elmer公司梁少霞参与了研究。该研究工作得到了国家重点研发计划、国家自然科学基金、广东省自然科学基金、广东省重点研发计划等项目的支持。