


骨肉瘤是最常见的原发恶性骨肿瘤,恶性程度高,极易发生肺转移。骨肉瘤基因组的高度异质性与生长信号的冗余,导致骨肉瘤的治疗目前尚无有效分子靶标。
2022年12月18日,华南肿瘤学国家重点实验室廖丹/康铁邦团队在Advanced Science发表题为靶向Rab22a-NeoF1融合蛋白溶酶体降解治疗骨肉瘤肺转移的研究,揭示Rab22a-NeoF1融合蛋白可被泛素化,经自噬溶酶体降解,该过程可被磷酸化调控,并发现正在临床上使用的靶向药物索拉菲尼和瑞戈菲尼,可诱导Rab22a-NeoF1融合蛋白的降解,因而可用于治疗该融合基因阳性的骨肉瘤患者。
 Advanced Science发表
Advanced Science发表近年来,在骨肉瘤的基础与转化研究方面有一系列研究,比如,率先报道了一类新的exon-intron融合基因(已知传统的融合基因均为exon-exon),由Rab22a(exon1和2,即1-38aa)连接于多个不同的内含子或非编码区,从而编码产生了新的融合蛋白Rab22a-NeoFs,该类融合蛋白均可结合SmgGDS607,促进RhoA的活化,促进骨肉瘤的肺转移。以Rab22a-NeoF1融合蛋白为例,发现其K7位乙酰化对该融合蛋白的功能起关键作用;该融合蛋白以传统的方式,分泌到外泌体,重塑肿瘤微环境中的免疫细胞和肿瘤细胞,促进骨肉瘤的肺转移。
廖丹/康铁邦团队的研究通过E3连接酶的CRISPR-Cas9文库,利用该团队前期建立的Pro-SRSA方法,成功筛选Rab22a-NeoF1融合蛋白的E3泛素连接酶STUB1,特异性泛素化Rab22a-NeoF1融合蛋白Lys112位,该泛素化被自噬降解受体NDP52识别并结合,通过自噬溶酶体途径降解。进一步通过CRISPR-Cas9蛋白激酶文库筛选、高通量小分子激酶抑制剂筛选,发现Rab22a-NeoF1融合蛋白的自噬溶酶体降解可被蛋白激酶PINK1调控,PINK1可磷酸化Rab22a-NeoF1融合蛋白Ser120位,该磷酸化促进Rab22a-NeoF1融合蛋白Lys112位点的泛素化及其被溶酶体降解;正在临床上使用的靶向药物索拉菲尼和瑞戈菲尼,可诱导PINK1上调,促进Rab22a-NeoF1融合蛋白Ser120位点的磷酸化、Lys112位点的泛素化、溶酶体降解,从而抑制Rab22a-NeoF1所诱导的骨肉瘤肺转移。
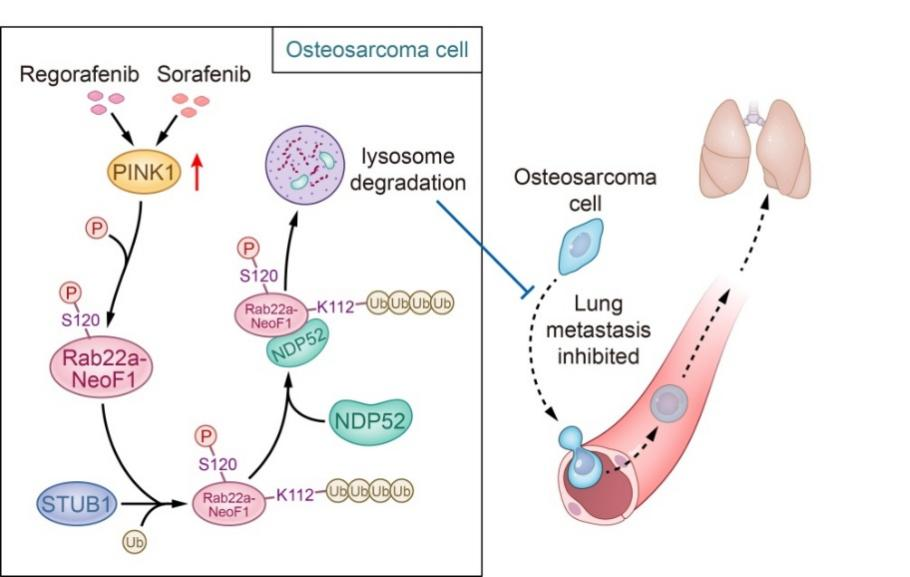 Rab22a-NeoF1融合蛋白的自噬溶酶体途径降解调控机制示意图
Rab22a-NeoF1融合蛋白的自噬溶酶体途径降解调控机制示意图总的来说,该研究通过Pro-SRSA方法、CRISPR-Cas9文库(E3连接酶、蛋白激酶)筛选、高通量小分子激酶抑制剂筛选等,从分子水平、细胞层面、动物模型等,全面诠释了Rab22a-NeoF1融合蛋白稳定性的关键泛素化、磷酸化调控机制,并利用该融合蛋白的自噬溶酶体降解机制。正在临床上使用的靶向药物索拉菲尼和瑞戈菲尼,可老药新用,用于Rab22a-NeoF1融合蛋白所诱导的骨肉瘤肺转移,为该融合基因阳性的骨肉瘤患者提供新的治疗方向。
中山大学肿瘤防治中心(华南肿瘤学国家重点实验室)博士研究生曾翠玲、中山大学附七院钟理副研究员、中山大学附五院硕士研究生刘文强为共同第一作者;华南肿瘤学国家重点实验室廖丹副研究员、康铁邦研究员为共同通讯作者。
研究团队介绍
康铁邦研究团队长期从事骨肉瘤肺转移及靶标筛选研究。近年来,康铁邦研究团队成员在Nat Cell Biol,Nat Cancer, Cell Res (3篇),J Clin Invest, Nat Commun等国际主流杂志上发表论著50多篇。课题组长期招聘博士后,欢迎有志者加盟!