


1月13日,国际细胞生物学顶级期刊《自然细胞生物学》(Nature Cell biology)在线发表了中山大学肿瘤防治中心朱孝峰和邓蓉团队的最新成果——“蛋白激酶C-βⅡ亚型通过磷酸化长链脂酰辅酶A合成酶4介导脂质过氧化迅速扩增促进铁死亡”。
中山大学肿瘤防治中心华南肿瘤学国家重点实验室的朱孝峰教授和邓蓉教授是本论文通讯作者,中山大学肿瘤防治中心华南肿瘤学国家重点实验室的张海亮博士是本论文的第一作者。

什么是“铁死亡”
铁死亡(Ferroptosis)是铁依赖的,脂质过氧化驱动的细胞程序性死亡方式。脂质过氧化物的清除受损或过度产生都会导致其积累,达到致死水平而触发铁死亡。研究发现,细胞内谷胱甘肽过氧化物酶4(GPX4)、溶质载体家族7成员11(SLC7A11)、铁死亡抑制蛋白1(FSP1)及GTP环化水解酶1(GCH1)等抗脂质过氧化系统在脂质过氧化物的清除中发挥重要作用。脂质代谢和铁代谢也参与了铁死亡的调控,长链脂酰辅酶A合成酶4(ACSL4)参与脂肪酸代谢继而有助于脂质过氧化物生成。含不饱和脂肪酸,特别是花生四烯酸(AA)或肾上腺酸(AdA)的脂质在脂氧合酶Lox,细胞色素P450还原酶POR及二价铁等的作用下发生过氧化参与铁死亡调控。
对铁死亡核心机制的研究将为其在肿瘤治疗上的应用打下基础
铁死亡与很多病理过程相关,如缺血再灌注损伤、神经退行性疾病、肿瘤等。有研究报道肿瘤的免疫治疗及放射治疗能通过诱导铁死亡抑制肿瘤生长。此外,肿瘤细胞通过淋巴道转移过程中吸收周围油酸,改变细胞膜质构成逃避铁死亡,促进转移。
鉴于铁死亡在肿瘤恶性进展及治疗中的重要作用,对铁死亡核心机制的阐明将为铁死亡在临床上的应用打下坚实基础。就目前而言,铁死亡相关的脂质过氧化清除与生成机制已有较多报道,但是,在铁死亡执行过程中,脂质过氧化的感知分子及其调控铁死亡作用机制尚不清楚。
中肿团队研究发现铁死亡过程中关键诱导因素
中山大学肿瘤防治中心朱孝峰和邓蓉团队通过成簇规律间隔短回文重复序列及其相关蛋白9(CRISPR-Cas9)及激酶抑制剂库筛选,发现蛋白激酶C-βⅡ亚型(PKCβII)发挥促进铁死亡的作用。进一步,作者鉴定了PKCβII是脂质过氧化物的感知分子,PKCβII的激活是铁死亡执行所必需的。
为阐明PKCβII诱导肿瘤细胞铁死亡的分子机制,作者利用免疫共沉淀、磷酸化位点预测、体外激酶、特异性磷酸化抗体制备及脂质组学等方法证实,PKCβII磷酸化ACSL4 T328位点,促进ACSL4激活。激活的ACSL4显著促进含不饱和脂肪酸磷脂的合成,进一步诱导脂质过氧化物的产生。这样,脂质过氧化-PKCβII- ACSL4正反馈轴的持续运转,启动了脂质过氧化的快速扩增过程,最终诱导铁死亡的发生。
作者在铁死亡相关的动物模型中进一步证实PKCβII磷酸化ACSL4迅速扩增脂质过氧化的过程在铁死亡中的作用。发现与ACSL4-WT(野生型ACSL4)相比,ACSL4-T328A(磷酸化失活突变型ACSL4)肿瘤对PD-1抗体敏感性下降。同样,敲除PKCβII显著抑制肿瘤对PD-1抗体的敏感性,过表达PKCβII能回复肿瘤的免疫治疗疗效,且铁死亡抑制剂显著抑制PKCβII介导的免疫治疗疗效增强。这表明PKCβII-ACSL4通过促进铁死亡增强免疫治疗疗效,提示PKCβII及ACSL4可作为肿瘤免疫治疗疗效的分子标记物和靶标。
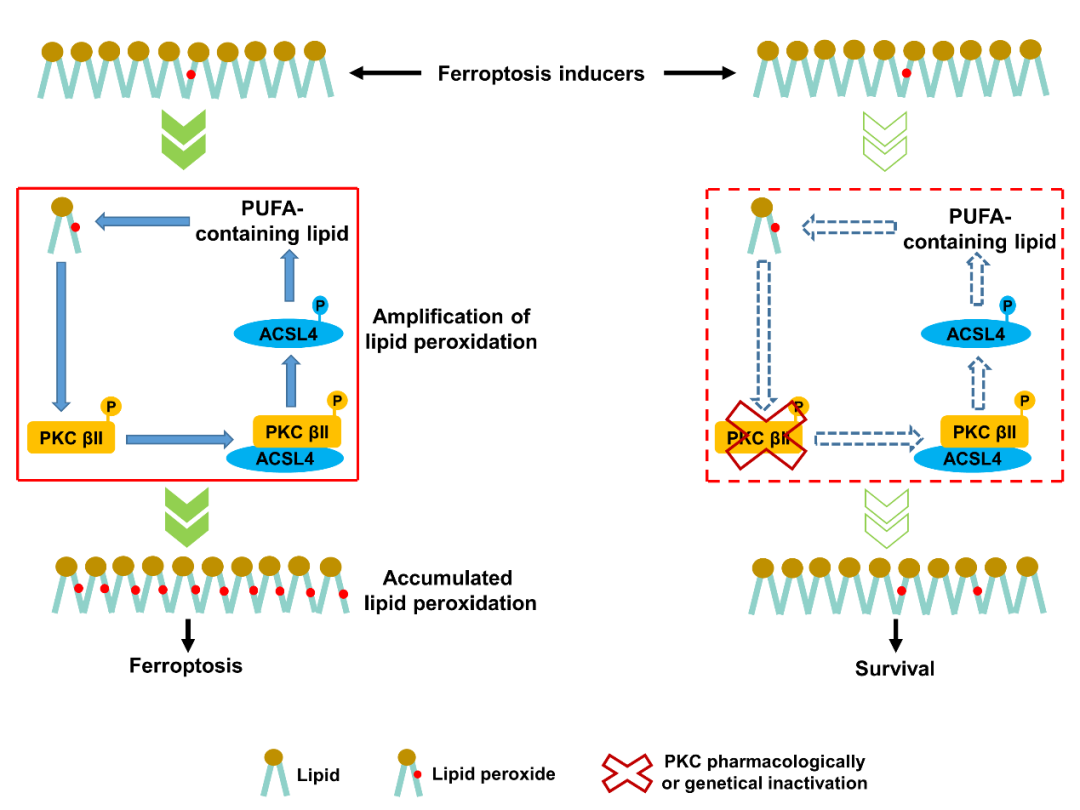
综上所述,本研究发现了铁死亡过程中脂质过氧化感知分子PKCβII;揭示了PKCβII介导脂质过氧化迅速扩增促进铁死亡的分子机制;提示脂质过氧化-PKCβII-ACSL4正反馈通路可为肿瘤等铁死亡相关的疾病治疗提供分子标志物及新靶标。