


雌激素受体阳性(ER+)乳腺癌是最常见的乳腺癌分子亚型。尽管内分泌治疗在临床上取得了较好的疗效,但仍有高达40-50%的ER+乳腺癌患者最终对内分泌治疗耐药并复发。2024年7月18日,Advanced Science在线发表了中山大学肿瘤防治中心邓蓉团队的最新研究成果:Inactivated cGAS–STING Signaling Facilitates Endocrine Resistance by Forming a Positive Feedback Loop with AKT Kinase in ER+HER2- Breast Cancer(点击阅读原文查看)。该研究首次揭示了cGAS-STING通路失活和AKT激酶过度激活形成的正反馈环路是乳腺癌内分泌治疗耐药的关键决定因素,发现了STING激动剂联用AKT抑制剂能显著阻断这一正反馈通路,为内分泌耐药乳腺癌患者提供了新的治疗策略。

内分泌治疗耐药是ER+乳腺癌患者疾病进展和复发的主要原因。已报道的内分泌治疗耐药机制很多,针对其耐药机制已被批准在临床上使用的药物主要有雌激素受体降解剂、CDK4/6抑制剂、PI3K/AKT/mTOR通路相关抑制剂等。但根据目前已有的效果来看,这些靶向药物的总体疗效不佳;并且约60%的内分泌耐药乳腺癌缺乏已知的体细胞耐药驱动因素,这些患者没有合适的靶向药物可以使用。
近年来,有研究尝试从免疫的角度治疗这些患者,遗憾的是,临床试验显示免疫检查点抑制剂并不能提高内分泌治疗耐药乳腺癌患者的生存。因此,深入研究内分泌耐药乳腺癌的肿瘤微环境特征,对提出行之有效的治疗策略至关重要。
针对以上临床问题,研究人员通过分析内分泌治疗耐药乳腺癌患者的Bulk转录组数据以及本院收集测序的空间转录组数据,发现与内分泌治疗敏感乳腺癌相比,耐药乳腺癌呈现出抑制性免疫微环境特征,感受细胞质DNA的天然免疫信号通路在肿瘤细胞中的富集程度显著下降,且是雌激素受体阳性(ER+)人表皮生长因子受体2阴性(HER2-)乳腺癌患者预后不良的独立因素。cGAS-STING信号通路是细胞中主要感受细胞质DNA的天然免疫信号。但该信号通路在内分泌治疗耐药乳腺癌中的作用尚不清楚。
随后,研究人员通过长期雌激素剥夺构建的内分泌治疗耐药细胞模型证明,内分泌治疗耐药细胞株中cGAS-STING通路的活性显著减弱,从而促进耐药细胞抵抗胞质双链DNA诱导的细胞死亡,并且抑制DC细胞的活性和T细胞的细胞毒作用。
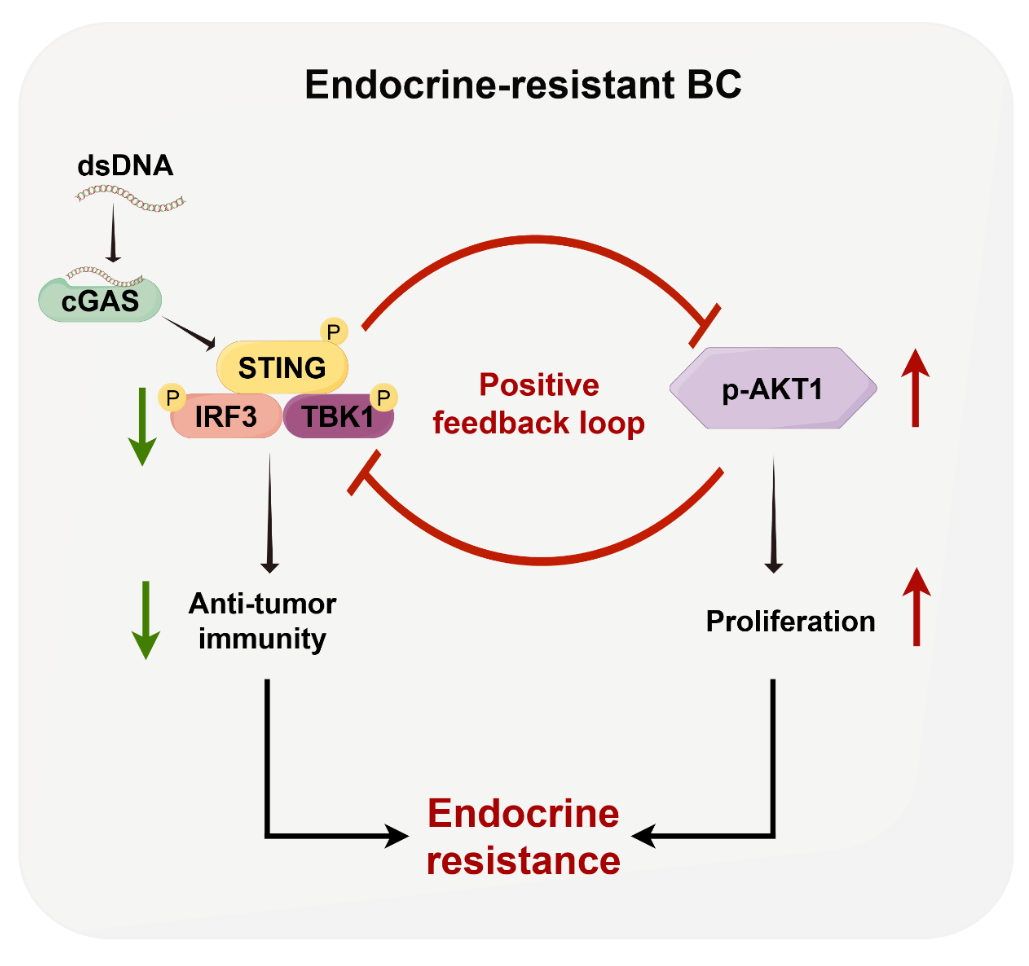
接下来,研究人员尝试解析内分泌治疗耐药乳腺癌中cGAS-STING通路失活的分子机制。他们利用激酶抑制剂库的筛选鉴定出AKT抑制剂可以显著恢复耐药细胞中cGAS-STING通路的活性。进一步的研究发现,激活的AKT激酶直接与TBK1的激酶结构域相互作用,降低TBK1与STING和IRF3的结合,从而导致cGAS-STING通路的阻断。反过来,研究人员发现cGAS-STING-IFN信号本身具有抑制AKT1激酶活性的作用,敲除STING可以显著增强AKT激酶的磷酸化,并促进ER+HER2-乳腺癌对内分泌治疗的抵抗。进一步通过在患者肿瘤组织标本中的多级相关性分析,发现cGAS-STING通路失活和AKT激酶的过度活化是内分泌治疗耐药乳腺癌的特征之一。至此,研究人员首次证实了cGAS-STING通路失活和AKT激酶过度激活形成的正反馈环路导致内分泌治疗耐受的分子机制,这是内分泌治疗抵抗的新模式。
最后,研究人员利用这一分子机制,提出联合使用STING激动剂和AKT抑制剂治疗内分泌耐药乳腺癌的治疗策略,并且在体外和人源化小鼠模型中验证了联合治疗可以阻断过度激活的AKT激酶抑制cGAS-STING信号这一正反馈环路,从而最大限度地激活cGAS-STING通路,一方面使内分泌治疗耐药乳腺癌从“冷”肿瘤转变为“热”肿瘤,全面增强抗肿瘤免疫应答,另一方面降低PI3K-AKT信号的活性,抑制耐药肿瘤的增殖。
研究示意图
该研究发现了cGAS-STING信号失活与AKT激酶的过度激活形成正反馈环路驱动ER+HER2-乳腺癌内分泌治疗耐药的新机制。首次从天然免疫的角度探讨内分泌耐药乳腺癌肿瘤微环境的特征,阐释了内分泌耐药乳腺癌免疫逃逸的机制,进一步完善了内分泌耐药乳腺癌的分子生物学特征。AKT激酶抑制剂Capivasertib已被批准用于内分泌耐药乳腺癌的治疗,另外STING激动剂也已进入临床试验,该研究提出的由STING激动剂和AKT抑制剂组成的联合治疗策略具有较高临床适用潜力。
华南恶性肿瘤防治全国重点实验室的邓蓉研究员是本论文通讯作者。中山大学肿瘤防治中心乳腺科的张开铭医师等是本论文的第一作者,同时,该研究还得到了中山大学肿瘤防治中心朱孝峰研究员和唐军教授的大力支持和帮助。

通讯作者 邓蓉
中山大学肿瘤防治中心实验研究部研究员、博士生导师、华南恶性肿瘤防治全国重点实验室学术秘书。现任中国老年保健协会肿瘤免疫治疗专委会副主任委员、中国抗癌协会抗癌药物专业委员会常务委员。长期致力于“肿瘤细胞死亡调控机制与靶向干预”的研究。以通讯/第一(含共同)发表SCI论文20余篇,包括Nature Cell Biology, Science Translational Medicine, Nature Communications, Advanced Science, Molecular Cancer, Clinical Cancer Research, Autophagy, Oncogene等国际知名肿瘤学期刊。主持包括国家自然科学基金(4项)在内的多项科研基金。