


胃癌是全球范围内致死率第三的癌症类型,患者通常只有不到40%的五年生存率,其中约10%的胃癌与EB病毒(EBV)相关。相比于EBV阴性胃癌,EBV阳性胃癌(EBV associated gastric carcinomas,EBVaGCs)具有独特的分子特征,包括PIK3CA高频突变、CDKN2A表达缺失、高甲基化等,这表明EBV在EBV阳性胃癌的肿瘤发生过程中可能扮演着重要角色。有研究提出,癌症恶化前的遗传变化与EBV感染有关。然而,EBV阳性胃癌肿瘤发生的分子时序以及介导其发展的驱动事件仍待阐述。

2021年9月8日,华南肿瘤学国家重点实验室钟茜课题组与北京大学生物医学前沿创新中心(BIOPIC)、北京未来基因诊断高精尖创新中心(ICG)白凡课题组合作在Genome Medicine 以研究长文的形式发表题为“从不典型增生到肿瘤过程中EBV和感染胃组织的基金组结构分析”的论文。
钟茜研究员、白凡研究员为论文的共同通讯作者。北京大学BIOPIC陈章华博士、陈西茜博士和中山大学肿瘤防治中心颜淑梅医生、张琦医生、刘尚鑫博士为并列第一作者。
该研究对来自于25个EBV阳性胃癌患者的123个样本,进行了全外显子组测序,EBV基因组测序以及甲基化测序,从而对EBV阳性胃癌发展过程中肿瘤细胞与EB病毒的基因组特征进行了系统的分析。
通过全外显子测序,研究者发现,EBV阳性胃癌和癌前病变中的重度不典型增生(high-grade dysplasia,HD)相比正常胃粘膜组织和轻度不典型增生(low-grade dysplasia,LD)具有更高的体细胞突变频率。EBV阳性胃癌中具有高频突变的基因主要富集在PI3K-Akt、染色质相关通路、细胞周期调控、Wnt和Notch通路,包括PIK3CA,PTEN,ARID1A,SMAD4,CTNNB1和NOTCH1等基因,其中PIK3CA和ARID1A在肿瘤中的突变频率高于其在癌前病变的突变频率。
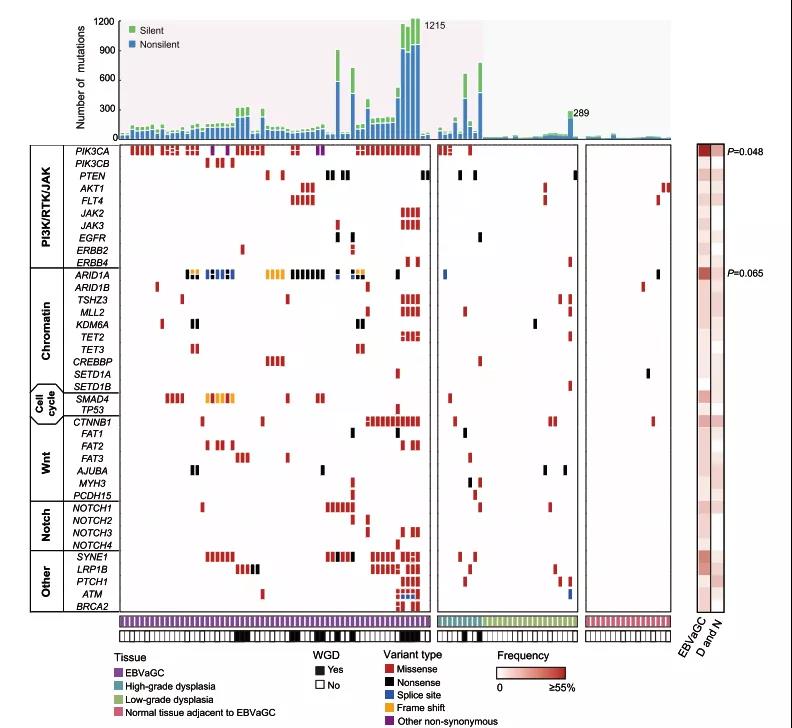
EBV阳性胃癌和癌前病变组织中的体细胞突变频率比较
研究者进一步对EBV基因组进行了分析,发现每个患者中EBV阳性胃癌和重度不典型增生的EBV序列高度一致,但是和正常组织以及轻度不典型增生中的EBV序列具有明显差异。另外,患者唾液中的EBV序列与EBV阳性胃癌中病毒序列也明显不一致,但是和正常胃黏膜组织以及轻度不典型增生中的EBV序列较为相似。研究者进一步发现,正常胃黏膜组织和轻度不典型增生的EBV基因组相比EBV阳性胃癌/重度不典型增生中的EBV具有更高比例的杂合性单核苷酸突变(SNVs)。这可能是正常组织和轻度不典型增生存在混合毒株或者不同毒株间的重组导致的,而EBV阳性胃癌和重度不典型增生中低比例的杂合性单核苷酸突变则进一步证明了它们具有单株来源的EBV。
高甲基化是EBV阳性胃癌的一个显著的分子特征。研究者通过全基因组甲基化测序发现,正常胃黏膜组织和轻度不典型增生的甲基化谱较为相似,但两者与EBV阳性胃癌有显著差异。基因通路富集分析显示这些区域包括信号转导和Wnt通路的负调控基因。研究者发现,相比于癌前病变以及其他类型的胃癌,EBV阳性胃癌中Ras GTPase激活蛋白(RasGAP)家族的一些基因(包括RASA3、RASA4、RASAL3等)启动子区域均为高甲基化状态,提示这些基因表达沉默可能会促进Ras的激活从而激活下游PI3K-Akt通路,以进一步驱动肿瘤的发展。
为了证实这一观点,研究者比较了胃癌细胞系AGS在EBV感染前后RasGAP家族基因的甲基化和表达水平,发现EBV感染之后RasGAP家族基因呈现出高甲基化、低mRNA水平等特征,RAS通路活性也随之升高;而通过使用甲基化抑制剂5-aza,则可以削弱上述效应。
通过整合肿瘤发展过程中不同阶段的分子事件,研究者发现EBV阳性胃癌和重度不典型增生具有高频的PI3K-Akt通路基因(PIK3CA/B, PTEN),Wnt通路基因 (CTNNB1,GNAS)和ARID1A的突变以及拷贝数变异,而这些变异事件在正常胃黏膜组织和轻度不典型增生中较为罕见。
结合PI3K-AKt和Wnt通路上游负调控因子启动子区域的高甲基化特征,研究者推测PI3K-Akt和Wnt通路的异常共同激活了EBV阳性胃癌和重度不典型增生中被EBV感染的细胞的克隆扩增,从而促进肿瘤发展。为了证明上述结论,研究者结合一系列体外和体内实验,证实PI3K抑制剂和Wnt通路抑制剂对具有PIK3CA和CTNNB1双突变的肿瘤细胞具有协同抑制作用。这揭示了同时使用这两种通路的抑制剂可以作为EBV阳性胃癌的一种潜在治疗策略。另外,通过研究EBV阳性胃癌中宿主细胞和EB病毒的基因组特征和分子时序,也为这一特殊类型的胃癌患者进行精准治疗提供了理论依据。