


鼻咽癌是起源于人鼻咽上皮组织的鳞状上皮癌,目前认为其发生是EB病毒(Epstein-Barr Virus)潜伏感染、遗传易感性以及环境等多因素、多步骤交互作用的过程。鼻咽癌组织中包含了恶性肿瘤细胞、免疫细胞、内皮细胞和成纤维细胞等种类繁多的细胞,这些细胞的多样化形成了复杂的肿瘤微环境。
日前,国际权威杂志《Journal for ImmunoTherapy of Cancer》在线发表了题为“PD-1+CXCR5−CD4+ Th-CXCL13 细胞亚群趋化B细胞进入鼻咽癌的三级淋巴样结构”的研究成果,华南肿瘤学国家重点实验室钟茜研究员为通讯作者,李江平博士后为第一作者。

三级淋巴样结构因其特殊的空间位置及强大的免疫功能,为抗肿瘤细胞和体液免疫应答提供场所,在肿瘤免疫中发挥着强大的功能。
近年来,科学家们通过不同途径,如开发使用趋化因子、细胞因子、抗体、抗原呈递细胞或合成细胞间支架以诱导三级淋巴结构形成多种方法来促进三级淋巴结构的发育,使其形成最高级别的生发中心结构,最终可达到抑制肿瘤生长的作用。
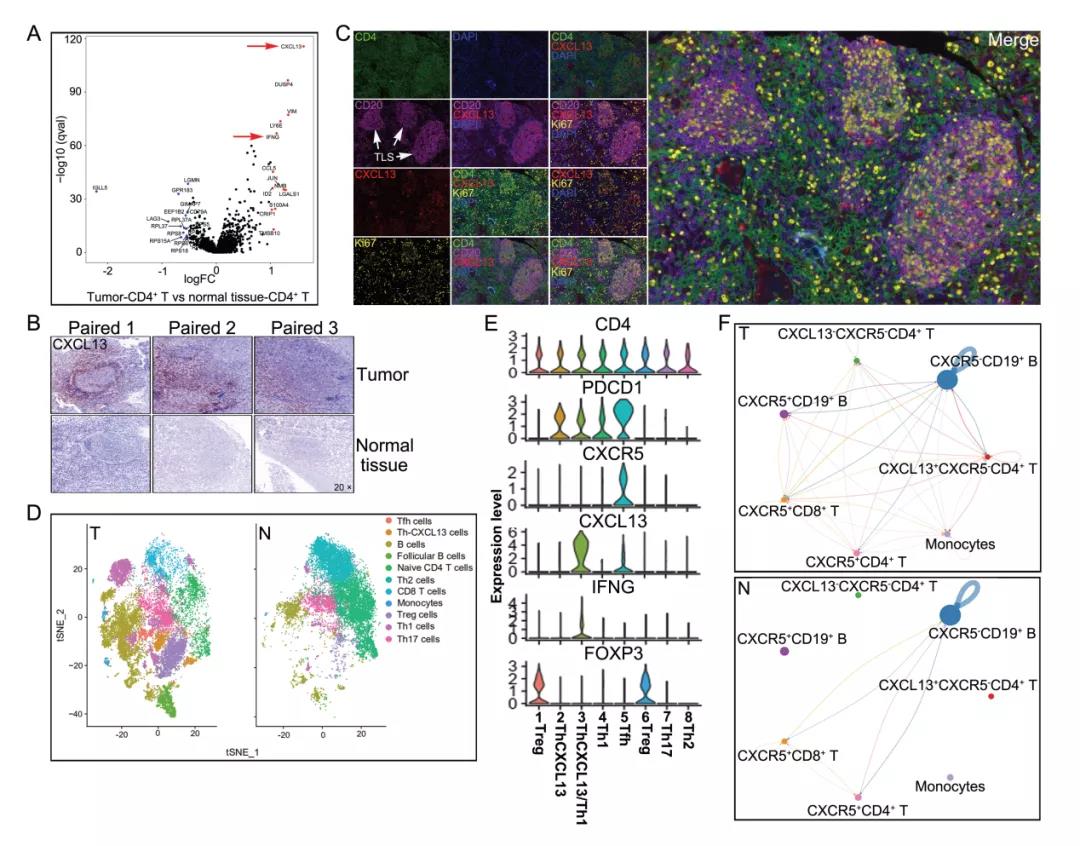
CD4+PD-1+CXCR5- T细胞主要集中在三级淋巴样结构中心周围,并共同表达Th1和Tfh相关的细胞表型。CD4+Th-CXCL13细胞还可通过产生的CXCL13与所对应表达在B细胞和CD4+T细胞上的趋化因子受体CXCR5相结合,进一步趋化T、B细胞来促进肿瘤微环境中卵泡样三级淋巴结构的形成与成熟。

CD4+PD-1+CXCR5- T细胞是肿瘤CXCL13的主要来源,它的高表达预示着肿瘤患者较好的预后
是什么原因造成这群细胞的产生及分化呢?
实验表明,肿瘤微环境局部形成了免疫抑制环境是造成这种现象的主要因素,其中高水平的转化生长因子β1 (TGF-β1)和低白介素-2(IL-2)环境可以促进多功能的CD4+Th-CXCL13细胞的分化,抗原呈递细胞分泌的促炎性细胞因子也可以诱导CD4+Th-CXCL13细胞的形成。
通过转录组测序提示,转录因子SOX4是这群细胞分化的关键转录调控因子,鼻咽癌免疫微环境高表达SOX4,可以促进了CD4+Th-CXCL13的分化,并预示着较好的生存周期。
在鼻咽癌微环境中,研究进一步发现PD-1+CXCR5-Tfh可以通过IL-21和CD84的相互作用来诱导肿瘤相关B细胞(Tumor-associated B cells, TABs)分化为浆细胞(CD138+)和产生免疫球蛋白(IgG、IgA和IgM),进一步形成三级淋巴结构结构,激活机体免疫功能,最终达到治疗肿瘤的作用。

PD-1+CXCR5-Tfh促进B细胞分化为浆细胞,产生免疫球蛋白

诱导CD4+PD-1+CXCR5-T细胞,分泌CXCL13,趋化T、B细胞介导TLS的形成,进一步促进浆细胞分化并产生抗体,产生持续有效的抗肿瘤作用
研究结果显示,通过诱导CD4+PD-1+CXCR5-T细胞,趋化T、B细胞介导三级淋巴结构的形成,进一步促进TABs分化并产生抗体,产生持续有效的抗肿瘤作用,提高了病人的生存率,为恶性肿瘤的免疫治疗提供了更多的可能。